Annals of Oncology (2019) 30 (suppl_5): v851-v934.

A cura della Dott.ssa Vanda Salutari
Ginecologa Oncologa, Fondazione Policlinico Universitario “A. Gemelli” IRCCS di Roma
PAOLA-1 / ENGOT-ov25 è il primo studio internazionale multicentrico,randomizzato, in doppio cieco di fase III nel quale si sono valutate l’efficacia e la sicurezza di olaparib in aggiunta a bevacizumab rispetto a bevacizumab da solo, come trattamento di mantenimento dopo la chemioterapia di prima linea in donne con tumore ovarico sieroso o endometrioide, delle tube di Falloppio o peritoneale, avanzato, di alto grado e in stadio III-IV della classificazione FIGO.
PAOLA-1 è uno studio ENGOT (European Network of Gynaecological Oncological Trial groups, del quale fanno parte anche i gruppi cooperativi italiani MITO e MANGO), sponsorizzato da ARCAGY Research (Association de Recherche sur les CAncers dont GYnécologiques) per conto di GINECO, il gruppo cooperativo francese per la cura dei tumori femminili.
L’attuale standard di cura per la maggior parte dei pazienti con carcinoma ovarico avanzato di nuova diagnosi è la chirurgia seguita da chemioterapia a base di platino combinata con bevacizumab, più dal solo bevacizumab per il mantenimento.
Lo studio ha arruolato 806 pazienti,indipendentemente dallo stato mutazionale e dal tipo o dall’esito dell’intervento chirurgico (upfront o di intervallo), che avevano risposto in modo completo o parziale al trattamento di prima linea con la chemioterapia contenente platino e bevacizumab per almeno 3 cicli.
Le partecipanti sono state assegnate in rapporto 2:1 al trattamento con olaparib in compresse alla dose di 300 mg due volte al giorno verso placebo per un massimo di 24 mesi più bevacizumab a 15 mg/kg al giorno ogni 3 settimane per 15 mesi, comprendenti anche le somministrazioni ricevute durante la chemioterapia. Le pazienti sono state stratificate in base all’esito del trattamento di prima linea e allo stato mutazione del BRCA somatico (tBRCA).
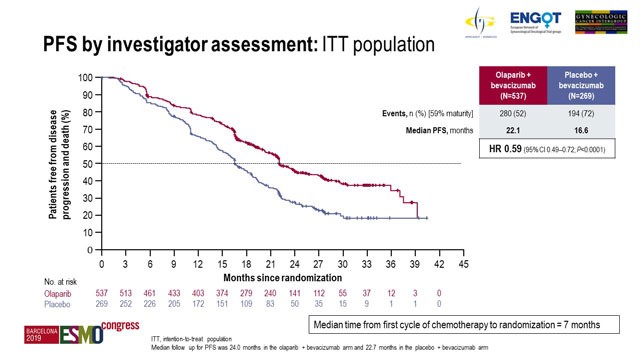
L’endpoint primario era la PFS valutata dallo sperimentatore secondo RECIST v1.1 nella popolazione intent-to-treat (ITT).Il follow-up mediano è stato di 24,0 mesi per 537 pazienti nel braccio con olaparib e 22,7 mesi per 269 pazienti nel braccio con placebo. L’analisi dei dati alla maturità del 59% ha dimostrato una PFS mediana di 22,1 mesi con olaparib rispetto a 16,6 mesi con placebo (hazard ratio [HR] 0,59; intervallo di confidenza al 95% [CI], 0,49-0,72; p <0,0001).
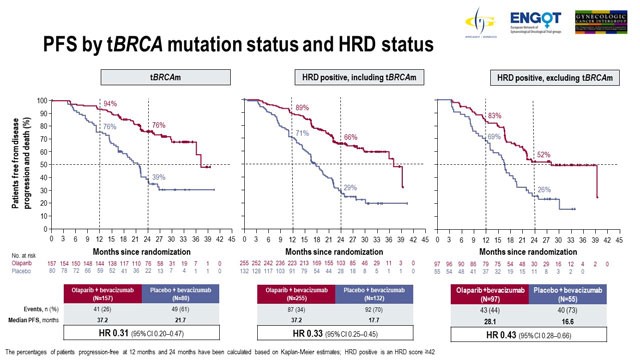
Sono stati inoltre presentati i risultati delle analisi di sottogruppo prespecificate nelle donne tBRCA mutate, tBRCA non mutate HRD positive e tBRCA non mutate HRD negative
Nello studio 237 pazienti presentavano una mutazione tBRCA e 569 pazienti erano tBRCA negative.
Le donne che hanno tratto maggiore beneficio dall’aggiunta di olaparib al mantenimento con bevacizumab sono risultate quelle con mutazioni somatiche di BRCA e quelle con difetto di riparazione omologa del DNA (HRD-positive), gruppo che comprende anche le donne con tBRCAm.
Tra i pazienti con mutazione tBRCA, la PFS mediana con trattamento con olaparib era di 37,2 mesi rispetto ai 21,7 mesi con placebo (HR 0,31; IC al 95% 0,20-0,47). I pazienti senza mutazione tBRCA hanno dimostrato una PFS mediana di 18,9 mesi con olaparib rispetto a 16,0 mesi con placebo (HR 0,71; IC al 95%, 0,58-0,88).
L’analisi in base allo stato della HRD ha mostrato che 387 pazienti erano HRD+; di questi 152 erano tBRCA non mutate. Lo stato HRD era negativo o sconosciuto per 419 pazienti. Nelle pazienti HRD +, la PFS mediana con olaparib era di 37,2 mesi rispetto a 17,7 mesi con placebo (HR 0,33; IC al 95%, 0,25-0,45). La PFS mediana nei pazienti non tBRCA mutate/HRD + trattate con olaparib è stata di 28,1 mesi contro 16,6 mesi con placebo (HR 0,43; IC al 95%, 0,28-0,66). Olaparib ha mostrato scarso effetto nelle pazientiHRD negative; in pazienti con stato HRD negativo o sconosciuto, la PFS mediana era di 16,9 mesi contro 16,0 mesi con olaparib rispetto al placebo (HR 0,92; IC al 95%, 0,72-1,17).
Il profilo di sicurezza e tollerabilità di olaparib in combinazione con bevacizumab è risultato in linea con quanto mostrato in studi precedenti per ciascuno dei farmaci.
Gli eventi avversi di grado ≥3 sono stati più frequenti nel braccio trattato con olaparib rispetto al gruppo placebo (57% contro 51%) e quelli riportati più comunemente sono stati ipertensione (19% contro 30%) e anemia (17% contro <1%). Inoltre, si sono registrati cinque eventi avversi fatali durante il trattamento, di cui uno nelle donne trattate con l’inibitore di PARP e quattro in quelle trattate con il placebo.
Sospensioni della somministrazione sono state necessarie per il 54% delle pazienti del braccio olaparib e il 24% di quelle del braccio placebo, mentre riduzioni della dose sono state richieste rispettivamente dal 41% e 7% delle pazienti e interruzioni del trattamento rispettivamente dal 20% e 6% delle pazienti. Nonostante ciò, non si è registrata alcuna differenza clinicamente significativa nella qualità della vita correlata alla salute tra i due bracci.
Da giugno 2019, olaparib è stato approvato in Europa in monoterapia come trattamento di mantenimento in prima linea per pazienti con carcinoma ovarico, delle tube di Falloppio o peritoneale primario avanzato (stadi FIGO III e IV) con mutazioni di BRCA, in risposta completa o parziale dopo la chemioterapia di prima linea a base del platino sulla base dei risultati dello studio SOLO 1.
In questo studio, il mantenimento con olaparib in monoterapia ha mostrato di ridurre il rischio di progressione della malattia o decesso del 70% rispetto al placebo in pazienti con carcinoma ovarico avanzato con mutazioni di BRCA che erano in risposta completa o parziale dopo la chemioterapia a base di platino (HR 0,30; IC al 95% 0,23-0,41; P < 0,0001).
Lo studio PAOLA-1, a differenza del SOLO-1, ha arruolato tutta la popolazione di pazienti con carcinoma sieroso di alto grado indipendentemente dalla mutazione del BRCA, al fine di valutare se il beneficio osservato con l’aggiunta di olaparib alla terapia di prima linea standard comprendente il bevacizumab, nelle pazienti BRCA-mutate potesse essere esteso anche alle altre pazienti senza la mutazione.
Confrontando i risultati di SOLO-1 con i risultati di PAOLA-1, nelle pazienti con mutazione di BRCA si è confermato il beneficio di olaparib osservato nello studio SOLO-1, con un hazard ratio quasi identico, pari a 0,31, il beneficio si mantiene estremamente elevato, pari a 0,33, anche nella popolazione con deficit della riparazione omologa (HRD positive).
È interessante notare che il PFS nel braccio di controllo nel PAOLA-1 è più lungo di quello riportato nello studio SOLO1, che è probabilmente dovuto all’uso di bevacizumab.
Inoltre nella popolazione HRD negativa olaparib non mostra un vantaggio statisticamente significativo in termini di sopravvivenza libera da progressione, sottolineando in questa popolazione il beneficio del bevacizumab in associazione alla chemioterapia.
Un altro aspetto molto importante dello studio è che olaparib può essere combinato con sicurezza alla terapia di I linea standard che comprende il bevacizumab, infatti gli eventi avversi osservati risultano in linea con quanto mostrato in studi precedenti per ciascuno dei farmaci.
Allo studio sono associati una serie di studi traslazionali che aiuteranno ad individuare eventuali fattori di risposta ai trattamenti e a personalizzare al meglio le combinazioni disponibili.
In conclusione, lo studio PAOLA-1 è un esempio positivo della forza e della promessa della collaborazione tra università e industria nel progresso della scienza e nuove opzioni terapeutiche per le pazienti.
Bibliografia
I.L. Ray-Coquard, et al. Phase III PAOLA-1/ENGOT-ov25 trial: Olaparib plus bevacizumab (bev) as maintenance therapy in patients (pts) with newly diagnosed, advanced ovarian cancer (OC) treated with platinum-based chemotherapy (PCh) plus bev. Annals of Oncology (2019) 30 (suppl_5): v851-v934. 10.1093/annonc/mdz394.
- Moore et al. Maintenance Olaparib in Patients with Newly Diagnosed Advanced Ovarian Cancer. N Engl J Med 2018; 379:2495-2505
 Italiano
Italiano English
English